Évaluation pharmacocinétique et pharmacodynamiques de l’utilisation du grapiprant dans un modèle de douleur inflammatoire induite par carraghéname chez le lapin
V. de Vito, M. Salvadori, A. Poapolathep et al. Pharmacokinetic/pharmacodynamic evaluation of grapiprant in a carrageenan-induced inflammatory pain model in the rabbit. J. Vet. Therap. 2016, 40: 469-475.
Introduction
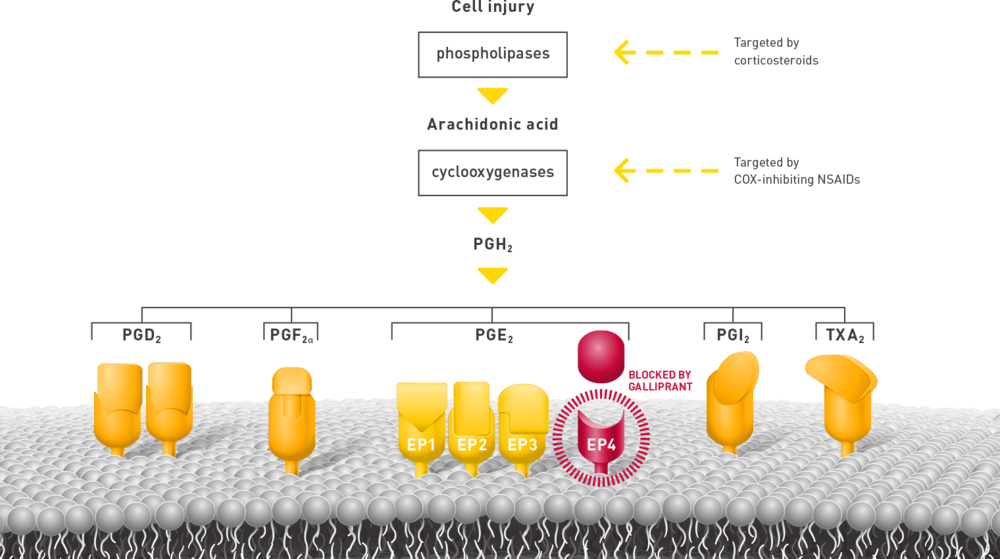
Le grapiprant est un inhibiteur sélectif des récepteur prostaglandines EP4 découvert en 2007. Les récepteurs EP4 sont les médiateurs primaires de la sensibilisation par les PGE2-Alpha des neurones sensitifs et de l’inflammation. Cette molécule a récemment reçu une autorisation de mise sur le marché chez le chien pour traiter la douleur chronique associée avec l’arthrose.
Le but de cette étude est d’étudier les propriétés pharmacocinétiques et l’efficacité analgésique lors d’un processus inflammatoire induit chez le lapin.

Matériels et méthodes
Douze lapins ont été utilisés et assignés au hasard à deux groupes (A et B ou C et D). Le groupe A (N=3) a reçu une dose unique par voie intraveineuse de grapiprant à 2mg/kg dissout dans de l’éthanol. Le groupe B (N=3) a reçu uniquement de l’éthanol IV (volume équivalent au grapiprant + éthanol). Le groupe C (N=3) a reçu une dose unique de meloxicam à 0,5mg/Kg par voie sous cutanée. Le groupe D (N=3) a reçu une dose unique d’éthanol 15% (volume équivalent au grapiprant) par voie sous cutanée. Après une période de washout de 2 semaines les groupes ont été intervertis et les expériences répétées.
Des prises de sangs ont été réalisées via l’artère auriculaire (à 0, 0,083, 0,25, 0,5, 0,75, 1, 1,5, 2, 4, 6, 8, 10 et 24 h) et la concentration plasmatique du grapiprant fut mesurée en utilisant une méthode validée chromatographie liquide à haute performance couplée à une détection par fluorescence.
Trois heures avant l’administration des molécules, les lapins ont reçu une injection sous cutanée de carraghénane (200µL, concentrée à 3% dans du sérum physiologique), au niveau de la surface plantaire du membre postérieur droit. Au moment de la réalisation de la prise de sang, un stimulus thermique (lampe infra rouge à 40°C) a été appliqué à la surface plantaire du membre postérieur droit pour évaluer la latence de retrait thermique. L’intensité des effets anti nociceptifs thermiques a été exprimée pourcentage de réponse maximum possible.
Résultats
La concentration plasmatique de grapiprant était détectable jusqu’à 10h après injection. La demi-vie terminale était de 2,18h et une concentration plasmatique maximale atteinte en 10 heures.
En comparaison au groupe contrôle, le groupe traité avec du grapiprant a montré une augmentation significative de la latence de retrait thermique à partir d’une heure et jusqu’à 10 heures après l’administration de la molécule. Le groupe traité avec du méloxicam avait une latence de retrait thermique augmentée de manière significative à partir de 4 heures et jusqu’à 10 heures après l’administration de la molécule. Les pourcentages de réponse maximum possible n’étaient pas significativement significatifs.
Discussion
Afin de déterminer l’efficacité d’une molécule sur une espèce cible, il est important de coupler une étude pharmacodynamique à une étude pharmacocinétique. En effet, en fonction des espèces, la concentration plasmatique efficace peut-être très différente. La pharmacocinétique peut permettre lors d’une étude préliminaire de déterminer la fréquence des prises de mesure lors de l’étude de pharmacodynamique. Mais malgré ces données, l’effet peut être prolongé par rapport à la concentration plasmatique qui est jugée comme faible. En comparaison des études pharmacocinétiques réalisées chez le chien, la clearance est plus rapide chez le lapin, et la demi-vie est plus courte.
Le modèle d’inflammation induite par une injection sous-cutanée de carraghénane est un modèle très largement utilisé dans la recherche sur les AINS. Cette injection permet d’induire un œdème, une inflammation et une hyperalgésie à son point d’injection propice à tester les effets analgésiques d’AINS.
Le grapiprant, en agissant sur les récepteurs EP4, n’inhibe pas la production de prostanoïdes à la différence des AINS inhibiteurs de COX. L’inhibition des productions des prostanoïdes par les AINS inhibiteurs de COX peut conduire à des effets secondaires comme des toxicités rénales, gastro-intestinales, hépatiques et des coagulopathies. De par son mécanisme d’action, ces effets devraient être minimisés lors d’utilisation du grapiprant. Cependant, le résumé des caractéristiques du produit chez le chien, décrit la présence de vomissements très fréquents (chez plus d’1 animal sur 10 animaux traités), des selles, molles, des diarrhées et des inappétences fréquentes (entre 1 et 10 animaux sur 100 animaux traités). Anatomiquement, le lapin est une espèce qui ne peut pas vomir. Cependant la nausée, la diarrhée et l’inappétence peuvent engendrer des conséquences dangereuses chez cette espèce. Même si ces effets secondaires n’ont pas été rapportés chez cette espèce, il est très important que des études de toxicité soient conduites avant toute utilisation clinique de cette molécule.
Une étude précédente a montré que l’utilisation 4 semaines du grapiprant une fois par jour à 2mg/Kg PO chez le chien induisait un effet nociceptif efficace. Dans cette étude, l’efficacité anti-nociceptif chez le lapin ne durant que 10 heures il semblerait qu’une administration deux fois par jour de la molécule soit justifiée. Cependant, dans cette étude, une administration unique du grapiprant a été réalisée, et il n’existe pas de données sur des administrations multiples qui pourraient induire un effet cumulatif. D’autre part, il serait intéressant de réaliser la même étude avec une administration orale de grapiprant, seule forme disponible sur le marché.
A retenir
Les résultats de cette étude montrent que l’utilisation du grapiprant semble très prometteuse chez le lapin dans le traitement de la douleur inflammatoire aigue, de par son action rapide et durable.
Cependant, la toxicité de cette molécule n’étant pas connue chez le lapin à des doses répétées, des études confirmant l’innocuité de cette molécule sont nécessaires avant de pouvoir l’utiliser en clinique.
Pour aller plus loin
Boyd, M.J., Berthelette, C., Chiasson, J.F., Clark, P., Colucci, J., Denis, D., Han, Y., Levesque, J.F., Mathieu, M.C., Stocco, R., Therien, A., Rowland, S., Wrona, M. & Xu, D. (2011) A novel series of potent and selective EP4 receptor ligands: facile modulation of agonism and antagonism. Bioorganic and Medicinal Chemistry Letters, 21, 484–487.
De Vito, V., Saba, A., Lee, H.K., Owen, H., Poapolathep, A. & Giorgi, M. (2015) Detection and quantification of the selective EP4 receptor antagonist CJ-023423 (grapiprant) in canine plasma by HPLC with spectrofluorimetric detection. Journal of Pharmaceutical and Biomedical
Analysis, 118, 251–258.
Dong, H., Sun, H., Magal, E., Ding, X., Kumar, G.N., Chen, J.J., Johnson, E.J. & Manning, B.H. (2008) Inflammatory pain in the rabbit: a new, efficient method for measuring mechanical hyperalgesia in the hind paw. Journal of Neuroscience Methods, 168, 76–87.
Murase, A., Okumura, T., Sakakibara, A., Tonai-Kachi, H., Nakao, K. & Takada, J. (2008) Effect of prostanoid EP4 receptor antagonist, CJ-042,794, in rat models of pain and inflammation. European Journal of Pharmacology, 580, 116–121.
Nagahisa, A. & Okumura, T. (2017) Pharmacology of grapiprant, a novel EP4 antagonist: receptor binding, efficacy in a rodent postoperative pain model, and a dose estimation for controlling pain in dogs. Journal of Veterinary Pharmacology and Therapeutics, 40,
285–292.




