Approche actualisée de la maladie arthrosique
Préambule
1° L’arthrose est une maladie dégénérative et inflammatoire.
2° L’arthrose est une maladie pluritissulaire et invalidante.
3° « Il n’y a pas une mais des arthroses » car les mécanismes physiopathologiques impliqués (endotypiques) peuvent être très différents selon les articulations atteintes et car les signes cliniques observables (phénotypiques) varient selon les principaux facteurs de risques.
4° « Il n’y a pas une mais des douleurs arthrosiques » de type mécanique, inflammatoire, neuropathique et ou nociplastique.
5° Il y a un 1er cercle vicieux physiopathologique délétère associant la baisse de la mobilité, l’amyotrophie, l’instabilité, l’ankylose à une sensibilité accrue à la douleur. Ces variables sont mesurables relativement objectivement.
6° Il y a un 2ème cercle vicieux physiopathologique délétère associant des émotions négatives sources d’anxiété, d’états dépressifs, d’irritabilité voire d’agressivité, de troubles du sommeil à une perception accrue de la douleur. Ces variables sont évaluables éminemment subjectivement.
Définition Arthrose OARSI 2015
« L’arthrose est un trouble des articulations mobiles caractérisé par un stress cellulaire et une dégradation de la matrice extracellulaire initiés par des micro et macro-lésions qui activent des réponses de réparation inadaptées, notamment des voies pro-inflammatoires de l’immunité innée. Elle se manifeste d’abord par un dérèglement moléculaire (métabolisme anormal des tissus articulaires) suivi de dérèglements anatomiques et/ou physiologiques (caractérisés par la dégradation du cartilage, le remodelage osseux, la formation d’ostéophytes, l’inflammation articulaire et la perte de la fonction articulaire normale), qui peuvent aboutir à une maladie. » (1)
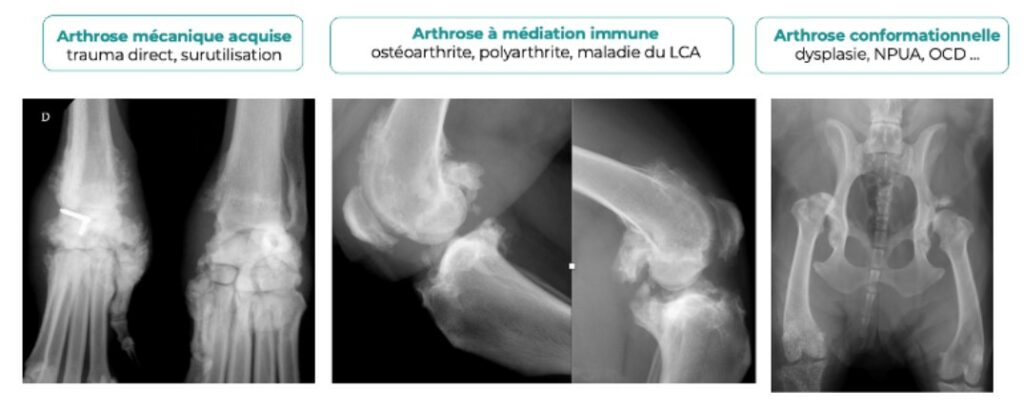
L’arthrose peut être conformationnelle (dysplasies), mécanique acquise (traumatisme direct, surutilisation) et/ou à médiation immune (ostéoarthrite, polyarthrite, maladie du ligament croisé crânial).
Approche actualisée de la maladie arthrosique
L’arthrose et les douleurs associées présentent des mécanismes physiopathologiques complexes, interconnectés mais néanmoins distincts.
Une approche actualisée de la maladie arthrosique conduit à une quadruple vision, endotypique tissulaire, endotypique mécanistique, phénotypique descriptive et individuelle (de l’animal douloureux).
1 Vision endotypique tissulaire
La vision endotypique tissulaire classe les mécanismes physiopathologiques distincts (voies de signalisation cellulaires, moléculaires et biomécaniques) susceptibles d’être pris pour cible.
L’arthrose est une maladie pluritissulaire, dégénérative et inflammatoire affectant le cartilage, l’os sous-chondral, la membrane synoviale, la capsule articulaire et les proches structures musculo-tendineuses.
L’endotype à commande cartilagineuse implique les chondrocytes qui secrètent des facteurs de croissance TGF, IGF, BMP (épaississement capsulaire, ostéophytose et sclérose sous-chondrale), des cytokines pro-inflammatoires IL-1 et TNF (élévation des taux de PGE2, de NO, de radicaux libres) et des enzymes de dégradation MMP (rupture des liaisons au collagène et chute de la résistance du cartilage).
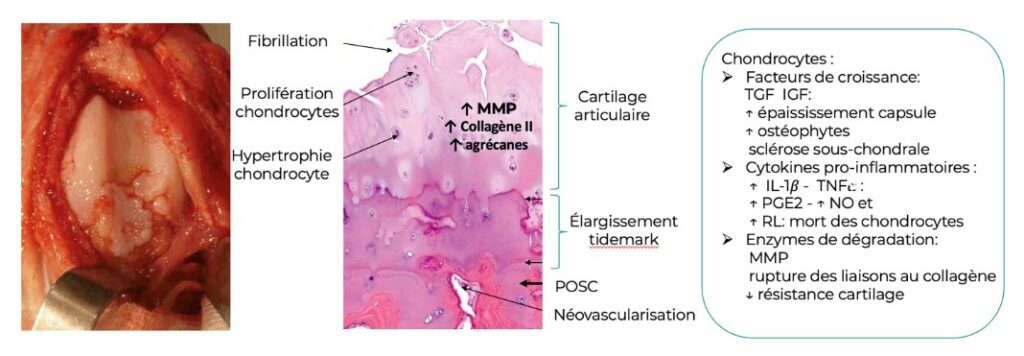
L’ensemble de ces stress cellulaires entraine des dérèglements anatomiques : fibrillation, fissuration, éburnation (disparition complète du cartilage) et production d’ostéophytes.
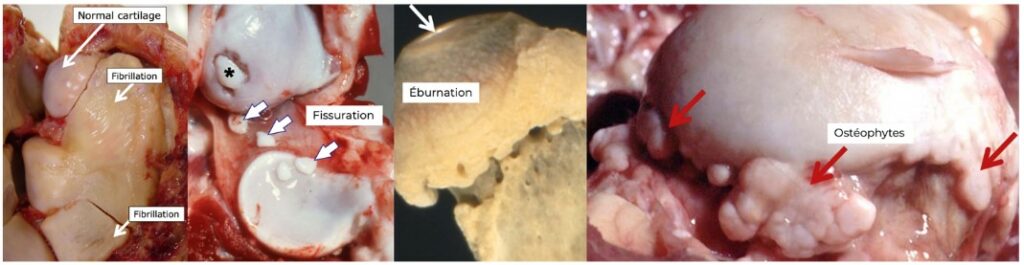
Contrairement au vieux principe de Hunter (18ème siècle) qui affirmait que la réparation cartilagineuse était impossible en raison de l’absence de vascularisation, la découverte récente de cellules progénitrices permet d’envisager des perspectives de réparation et de régénération, à condition d’intervenir précocement et de corriger les désordres biomécaniques (obésité, troubles axiaux …) (2)
L’endotype à commande osseuse implique l’activation des ostéoclastes (résorption osseuse et libération de médiateurs pro-inflammatoires). Des bouleversements histologiques particulièrement algogènes (inflammation via l’Il-1, néovascularisation via le VGEF et néo-innervation via le NGF entrainent un œdème et une sclérose sous-chondrale délétère, limitant les fonctions protectrices de soutien mécanique.
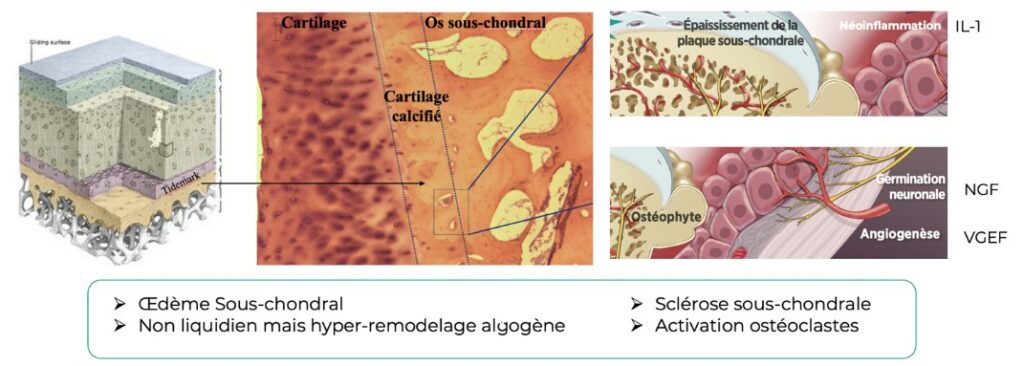
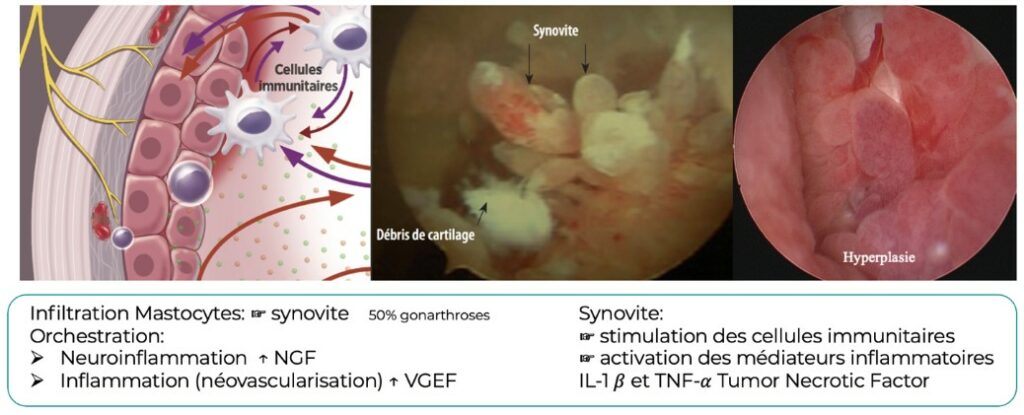
L’endotype à commande synoviale implique les mastocytes qui infiltrent la membrane synoviale et orchestrent la neuroinflammation via le NGF et l’inflammation (néovascularisation) via le VGEF.
La dégradation de la matrice extra cartilagineuse est ainsi à l’origine de tentatives de réponses inadaptées par les voies pro-inflammatoires de l’immunité innée. L’inflammation altère la qualité du liquide synovial (perte de la viscosité) et augmente la pression intra-articulaire (effusion). La synovite aiguë évolue vers la chronicité, avec l’apparition d’une fibrose et d’une hyperplasie de la membrane synoviale. Cet endotype à commande synoviale confirme la réalité d’une inflammation chronique de faible intensité, évoluant possiblement selon des poussées inflammatoires imprévisibles et d’intensité variable. (3)
La vision pluritissulaire de la physiopathologie de l’arthrose, issue directement des données fondamentales et des études d’imagerie (IRM), pourrait aboutir dans un futur proche à des traitements personnalisés selon les atteintes tissulaires cartilagineuses (sprifermine, liraglutide, inhibiteurs ADAMT…), osseuses (biphosphonates…) et/ou synoviales (anti-IL-1β et anti-TNF). (4)
2 Vision endotypique mécanistique
La vision endotypique mécanistique de la douleur classe les mécanismes physiopathologiques susceptibles d’être pris pour cible.
Rappel : Définition Douleur IASP (International Association for the Study of Pain) 2020
La définition officielle de la douleur proposée par l’IASP a été récemment revue. Elle prend désormais en compte la difficulté́ d’expression de leur douleur par certains patients, du fait d’une absence de verbalisation ou de difficulté à communiquer. Ainsi, la douleur est définie comme : « une expérience sensorielle et émotionnelle désagréable associée ou ressemblant à celle associée à une lésion tissulaire réelle ou potentielle ». (5)
Six notes clés complètent cette nouvelle définition.
- 1 et 2 : des facteurs biologiques, psychologiques et sociaux participent à la construction de douleurs individuelles qui ne sauraient être confondues avec les mécanismes neuronaux exclusivement nociceptifs (assurant la détection, conduction, transmission et modulation d’influx nerveux perçus comme douloureux).
- 3, 4 et 5 : les effets néfastes des douleurs chroniques sur l’histoire de l’individu, sa mobilité́ et son bien-être sont reconnus et doivent être pris en considération.
- 6 : le changement essentiel de cette définition, par rapport à la version de 1979, réside dans la reconnaissance de la capacité d’une personne à décrire, d’une façon ou d’une autre, l’expérience de douleur. La version 1979 excluait de facto les êtres vivants non verbalement communicants : nourrissons, handicapés (affections neurodégénératives, déficit cognitif), états comateux … et les animaux.
Approche mécanistique des douleurs arthrosiques
Les douleurs arthrosiques ont pour origine le compartiment articulaire (douleurs mécaniques, inflammatoires et neuropathiques) et le compartiment central (nociplastiques) (6) :
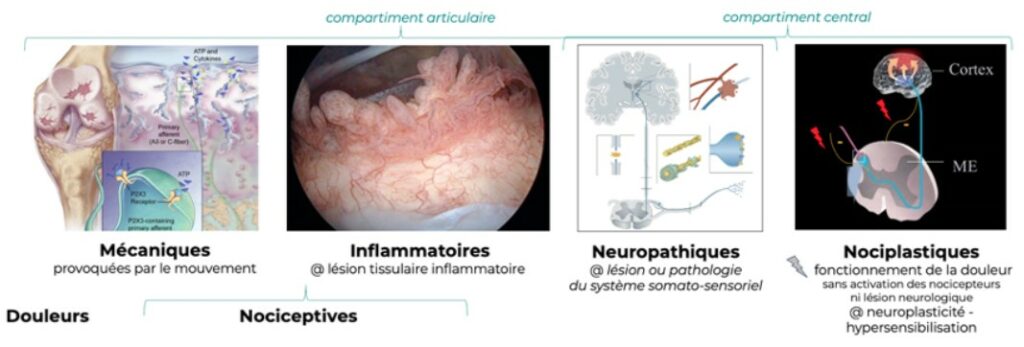
2.1 Compartiment articulaire
Les terminaisons nerveuses libres sont réparties autour et dans le compartiment articulaire (membrane synoviale, os sous-chondral, capsule articulaire, tendons, ligaments, muscles) à l’exception du cartilage.
2.1.1 Les douleurs nociceptives mécaniques
Elles sont liées à l’activation des récepteurs périphériques par une lésion tissulaire locale, provoquées par le mouvement et qualifiées “d’horaire mécanique”, augmentant à l’exercice et régressant au repos.
2.1.2 Les douleurs nociceptives inflammatoires
Elles sont liées à l’activation des récepteurs périphériques par une lésion tissulaire locale en relation avec l’inflammation et qualifiées “d’horaire inflammatoire”, présentes au repos, nocturnes, régressant à l’exercice, et responsables de la raideur matinale.
2.1.3 Les douleurs neuropathiques
Elles sont causées par une lésion ou une maladie du système somato-sensoriels, en relation avec une hyperexcitabilité électrique et chimique ainsi qu’un défaut des contrôles inhibiteurs descendants. Le recouvrement des surfaces articulaires par les ostéophytes piège les ramifications nerveuses périostées et provoque des douleurs neuropathiques.
Les douleurs neuropathiques sont spontanées, de type décharges électriques, accompagnées de paresthésies et dysesthésies (picotements, fourmillements, engourdissements) et réfractaires aux traitements anti-inflammatoires.
2.2 Compartiment central
Les douleurs nociplastique
Elles sont liées à liées à une perturbation du fonctionnement de la douleur sans activation des nocicepteurs ni de lésion neurologique. Elles s’accompagnent d’une hyperalgésie, d’une allodynie et de fréquentes comorbidités émotionnelles : anxiété́ (peur d’avoir mal), état dépressif, irritabilité, agressivité́, troubles du sommeil, pertes des liens sociaux et affectifs, etc.
Les douleurs dues à l’arthrose évoluent selon de très nombreux paramètres tels que la progression de la maladie, la sensibilité́ interindividuelle (génétique), les conditions environnementales (climat, mode de vie, relation propriétaire-animal), la nutrition, l’exercice, l’efficacité thérapeutique, etc. Elles sont à l’origine d’une fonte musculaire et d’un déclin affectif et cognitif qui viennent diminuer la sensibilité nociceptive et participent donc aux deux cercles vicieux de la chronicité́ de la douleur.
Les douleurs arthrosiques ne sont pas liées directement aux modifications structurales.
Les douleurs arthrosiques ne sont ni stables, ni linéaires.
L’évaluation des douleurs arthrosiques doit être :
- Quantitative : légère, modérée, sévère à très sévère.
- Qualitative en relation avec des anomalies neuropathiques (spontanées, en décharges électriques, paresthésies, dysesthésies) et/ou des mécanismes d’amplification centrale (hyperalgésie, allodynie).
- Inscrite dans un parcours de suivi en raison de la nature multimorphe de la douleur arthrosique et de son évolution défavorable (progression de la maladie) ou favorable (réussite du projet thérapeutique).
3 Vision phénotypique descriptive
La vision phénotypique est une classification descriptive, définissant des sous catégories cliniques plus homogènes, en relation avec des facteurs de risques prépondérants : (7)
- Arthrose métabolique en relation avec la sécrétion d’adipokines à diffusion systémique, supports d’un état inflammatoire chronique.
- Arthrose post traumatique et/ou post dysplasique en relation avec des contraintes mécaniques, sources de libération de médiateurs chimiques et donc d’une inflammation chronique de faible intensité.
- Arthrose liée au vieillissement en relation avec la sénescence accrue des chondrocytes, un déficit des activités cognitives et une cachexie induite par la fréquente multimorbidité.

Les recommandations deviennent plus adaptées au contexte clinique et autorisent une hiérarchisation des priorités thérapeutiques : chirurgie, traitements pharmacologiques, biothérapies, physiothérapie, ostéopathie, acupuncture …
4 Vision individuelle de l’animal douloureux
Les nombreux mécanismes physiopathologiques complexes, la grande hétérogénéité des syndromes cliniques, la forte variabilité de l’expression et l’imprévisibilité de son évolution conduisent à une vision individuelle de l’animal douloureux.
Soigner l’animal douloureux, c’est tenir compte de son identité et de son histoire replacées dans son environnement émotionnel et cognitif.
Soigner l’animal douloureux, c’est adopter la médecine des 6P :
- Personnalisée en fonction des caractéristiques individuelles, du profil de risque génétique et environnemental
- Préventive tertiaire pour diminuer la fréquence et la sévérité des rechutes

- Prédictive par la connaissance des facteurs de risque (approche phénotypique) et des mécanismes (approche endotypique)
- Participative en engageant le propriétaire dans le double processus de l’alliance et de l’éducation thérapeutiques

- Pertinente c’est-à-dire fondée sur les preuves (médecine factuelle) et la recherche pragmatique observationnelle
- Inscrite dans un Parcours proposant une médecine pro-active (versus réactionnelle) et une approche pluridisciplinaire.

Abréviations :
ACM : Anticorps monoclonal
BMP : Bone morphogenetic protein
CSM: Cellules souches mésenchymateuses
DMOAD : Disease Modifying OsteoArthritis Drug)
IDO : Indoléamine 2-3 dioxygénase 1
IGF : Insuline Growth Factor
IL-1β : Interleukine 1 béta
IL1Ra: Interleukin-1 receptor antagonist
IL10: Interleukine 10
KGF: Keratinocyte Growth Factor
MMP : Métalloprotéinases matricielles
NGF: Nerve Growth Factor
NO : Monoxyde d’azote
OARSI: Osteoarthritis Research Society International
PGE2 : Prostaglandine E2
PRP : Plasma riche en plaquettes
TGF-β: Transforming growth factor
TNF : Facteur de Nécrose Tumorale alpha
VGEF: Vascular Endothelial Growth Factor
Bibliographie
1 Kraus VB.et al. Call for standardized definitions of osteoarthritis and risk stratification for clinical trials and clinical use. Osteoarthritis Cartilage. 2015 Aug;23(8):1233-41.
2 Dell’accio F, et al.. Joint surface defects: clinical course and cellular response in spontaneous and experimental lesions. Eur Cell Mater 2010;20:210-7.
3 Sellam J, Berenbaum F. The role of synovitis in pathophysiology and clinical symptoms of osteoarthritis. Nat Rev Rheumatol 2010;6:625-35.
4 Trouvin A-P, Perrot S. New concepts of pain. Best Pract Res Clin Rheumatol 2019;33:101415),
5 Raja SN et al. The revised International Association for the Study of Pain definition of pain: concepts, challenges, and compromises. Pain. 2020 Sep 1;161(9):1976-1982.
6 Trouvin AP, Perrot S. Douleur dans l’arthrose : comprendre les mécanismes pour améliorer la prise en charge. Revue du rhumatisme 85 (2018) 324–330
7 Sellam J. De l’arthrose aux arthroses : une nouvelle vision physiopathologique. Bull. Acad. Natle Méd., 2018, 202, nos 1-2, 139-152, séance du 27 février 2018
Découvrir plus d'articles

Système de notation de la douleur chez les chevaux hospitalisés pour des affections ophtalmiques
Lire plus »