Controverse tramadol : l’absence de preuve n’est pas preuve d’absence
Une étude récente menée par SC Budsberg et collaborateurs discrédite l’utilisation du tramadol pour la prise en charge des douleurs chroniques arthrosiques (1).
Le comité de suivi du médicament vétérinaire en relation avec l’Agence nationale du médicament vétérinaire (Anses-ANMV) a analysé en février 2019 cet article et s’interroge sur l’efficacité antalgique du tramadol chez le chien.
Le comité conclut :
Il est important de noter qu’une AMM repose sur l’établissement d’un rapport bénéfice/risque propre au produit en cours d’évaluation. Les bénéfices thérapeutiques peuvent, comme mentionnés dans cet article, être faibles, à condition que le rapport bénéfice/risque reste positif et c’est en ce sens que le générique de tramadol a été autorisé, accompagné d’un RCP qui reflète précisément ce rapport.
Nous avons réalisé 2 enquêtes de pratiques de prescription du tramadol à 2 ans d’intervalle.
Nous rappelons qu’une enquête de pratiques de prescription a pour but de décrire la pratique des professionnels de santé dans une situation clinique donnée : il s’agit en quelque sorte d’une photographie, d’un état des lieux sans préjuger du bien-fondé de la prescription
L’enquête de 2018 révèle que pour le chien, le tramadol est prescrit 1 à 2 fois par mois par la moitié des vétérinaires, 2 à 3 fois par semaine par 40 % d’entre eux, jamais ou au moins une fois par jour par au plus 5 % des praticiens. Il est probable que la récente offre d’un générique vétérinaire majore ces chiffres en affranchissant les vétérinaires des difficultés de reconditionnement pour les animaux de petit format.
Les prescriptions concernent par ordre de fréquence, les douleurs arthrosiques inflammatoires, cancéreuses, neuropathiques et post-opératoires.
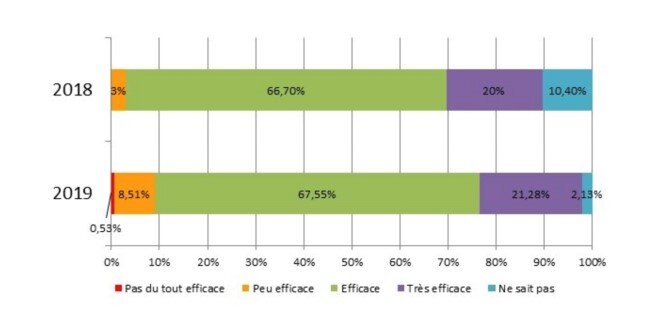
Les praticiens jugent la molécule efficace (67%) à très efficace chez le chien (20%), (42% et 11% chez le chat).
La deuxième enquête a été menée en décembre 2019, auprès des vétérinaires praticiens (188 répondants) pour évaluer les changements de prescription et les jugements d’efficacité suite à l’arrivée d’un produit enregistré avec AMM vétérinaire (Tralieve) et suite à la parution de différentes publications et controverses sur le sujet.
Les vétérinaires prescrivent le tramadol de plus en plus souvent chez le chien (60% versus 44%). L’efficacité perçue n’a pas changé (88% jugent efficace à très efficace chez le chien, 54% chez le chat). 50% des praticiens constatent des disparités d’efficacité.
Au cours des très nombreuses formations CAPdouleur de ces dernières années, une large proportion de cliniciens rencontrés dans une trentaine de villes en France confirme ce ressenti d’efficacité dans la prise en charge de la douleur.
Comment expliquer ce gap entre le manque de preuves de la médecine factuelle (essai clinique randomisé croisé en double aveugle, contre placebo et substance active) et l’utilisation plébiscité par une large majorité de cliniciens ?
L’étude de SC Budsberg et collaborateurs (1) présente un certain nombre de biais lié à la méthodologie et ne tient pas compte des derniers modèles de conceptualisation de la douleur (modèle constructionniste) permis par les progrès des neurosciences et de l’éthologie.
- Dès l’introduction de leur article, les auteurs expliquent le bien-fondé de leur étude : Dénoncer l’absence de rigueur des confrères américains, trop fortement influencés par une diffusion non contrôlée d’assertions pseudo-scientifiques dans des revues sans comité de lecture, des journées de formation continue ou sur des forums vétérinaires.
Ce parti pris est déjà un jugement de valeur venant obérer une objectivité pourtant revendiquée. - La taille d’échantillon calculée pour une étude croisée (chaque chien reçoit tour à tour chacun des 3 traitements selon un ordre aléatoire : tramadol, carprofène, placebo) est correcte (35 chiens). Cependant la sélection de différents types d’arthrose (coude et grasset) aurait dû imposer un doublement de l’échantillon car les douleurs engendrées diffèrent selon le type d’articulation : Compte tenu de la répartition du poids (60% sur les antérieurs, 40% sur les postérieurs), les contraintes mécaniques sont différentes ; la sarcopénie associée, la douleur des frottements osseux et l’ankylose sont plus sévères pour l’articulation du coude.
Les poids des chiens sélectionnés varient entre 15 et 50 kg : les expressions de la douleur et du handicap fonctionnel diffèrent selon le format et il aurait donc été judicieux de diviser l’échantillonnage en petit, moyen, et grand chien (35 par catégorie).
Enfin les périodes de wash out de 7 jours après les traitements successifs de 10 jours uniformisent la procédure sans tenir compte des modes d’action spécifiques de chaque molécule (anti-inflammatoire pour le carprofène, antinociceptif et modulateur des contrôles inhibiteurs descendants pour le tramadol). - Les critères de sélection retenus (exclusion des maladies systémiques associées, monothérapie analgésique) sont bien éloignés des situations cliniques rencontrées (animaux âgés douloureux chroniques) et des recommandations consensuelles (analgésie multimodale et pluridisciplinaire).
- Il manque une 4ème catégorie (carprofène + tramadol) qui aurait permis d’évaluer la synergie des modes d’actions des 2 principes actifs.
- Les critères d’évaluation de la fonction sont les forces de réaction verticale au sol (IV : impulsion verticale et PVF: force verticale maximale). Ces paramètres ont été mesurés au niveau des 4 membres au moyen de 2 plateformes de force en série et analysés par un logiciel informatique dédié.
Ces mesures apportent incontestablement de l’objectivité dans la détection des boiteries : il ne faut pas oublier qu’elles sont réalisées au cours d’un temps et d’une vitesse donnés, dans un milieu contraint, en dehors de l’environnement familier et en présence d’individus inconnus (prédateurs potentiels). Ainsi il faut bien évidemment accepter qu’elles ne soient pas le reflet exact des composantes inflammatoires parfois imprévisibles et des composantes neuropathiques toujours spontanées.
Enfin on connaît l’importance de la situation environnementale et des attentes émotionnelles dans l’expression de la douleur (cf infra). - La grille multiparamétrique utilisée est la Canine brief pain inventory (CBPI) qui évalue sous la forme d’une échelle numérique graduée de 0 à 10, l’intensité des douleurs maximales, minimales et moyennes durant les 7 derniers jours et le jour actuel (PS : Pain Severity ou score de gravité de la douleur). 6 autres questions interrogent la manière dont la douleur interfère avec les activités physiques (IP : Interference Pain ou score d’interférence de la douleur).
L’étude de Brown (2) s’est intéressée aux relations entre IV, PVF, PS et PI dans la même cohorte de chiens souffrant d’arthrose (70 chiens) : elle a montré qu’il n’y avait pas de concordance ou de corrélation entre les forces de réaction verticale au sol et les scores de douleur relevés par les propriétaires sur la grille CBPI. Ces mesures quantifient donc différents aspects de la douleur chronique du chien : Alors que l’IV et la PVF quantifient l’impact mécanique de la douleur sur la boiterie, le CBPI semble quantifier l’impact de la douleur sur les activités de la vie quotidienne (capacités et motivations). - Enfin « last but not least », les auteurs semblent résumer la douleur à la seule détérioration fonctionnelle en négligeant la coloration émotionnelle associée, venant altérer significativement et progressivement le comportement et la qualité de vie de l’animal.
La recherche dogmatique de critères objectifs est incompatible avec la nature intrinsèquement subjective de la douleur.
L’article cité rejette également l’objectivité des conclusions de l’étude Malek (3) qui montre une efficacité comparable entre le carprofène et le tramadol versus un antagoniste TRPV et un placebo (49 chiens présentant une coxarthrose). L’auteur reproche le manque de critères objectifs pour évaluer la douleur, résumant donc une nouvelle fois cette dernière à la seule évaluation de la fonction.
La douleur est pourtant une sensation et une expérience émotionnelle désagréable en réponse à une atteinte tissulaire réelle ou potentielle ou décrites en ces termes (IASP 1979). Cette définition associe les dimensions sensorielles, affectives et émotionnelles, rend compte des mécanismes générateurs physiques et/ou psychologiques, autorise une évaluation quantitative et qualitative par l’étude des 4 composantes fondamentales de l’expérience de la douleur :
- La composante sensori-discriminative qui renseigne sur le lieu, la durée, la qualité et l’intensité de la douleur.
- La composante émotionnelle qui confère à la douleur le caractère plus ou moins désagréable, plus ou moins pénible et plus ou moins supportable.
- La composante comportementale représentée par l’expression verbale (vocalises, plaintes), non verbale (mimiques, postures), motrice (jeux, sauts, dynamisme), relationnelle (désintérêt, irritation, agressivité).
- La composante cognitive qui chez l’Homme participe à la construction de l’image de la douleur et à son devenir.
Le neurophysiologiste Bernard Calvino (4) insiste bien sur le caractère éminemment subjectif de la douleur : la douleur devient l’expérience subjective d’une sensation émotive déplaisante, considérée comme résultant de processus adaptatifs tant nerveux que chimiques au sein de réseaux de neurones situés à différents niveaux du système nerveux central, dont les composantes peuvent augmenter ou diminuer en fonction des caractéristiques du stimulus, de l’état du sujet et du contexte dans lequel ce stimulus est appliqué.
Selon notre confrère Daniel le Bars, la douleur ne s’élabore pas dans un cerveau amnésique, mais au sein d’un système nerveux façonné par le passé singulier et les expériences de chacun (5).
L’expérience de la douleur est ainsi une construction dynamique influencée par le vécu (et donc la vulnérabilité du patient), par son état émotionnel et cognitif ainsi que son environnement immédiat (milieu de vie et relation avec le propriétaire).
La douleur ne se mesure pas objectivement : elle ne peut que s’évaluer subjectivement.
La douleur chronique ne se traite pas comme un symptôme mais comme une maladie à part entière : En mai 2019, l’Organisation Mondiale de la Santé cite enfin la douleur chronique dans la classification internationale des maladies (CIM-11)
https://www.who.int/fr/news-room/detail/18-06-2018-who-releases-new-international-classification-of-diseases-(icd-11)
Ces définitions évolutives ont le grand intérêt d’élargir les champs thérapeutiques et de dépasser les strictes recommandations uniformes pour s’intéresser à l’histoire de l’animal douloureux et de sa vulnérabilité particulière.
La prise en charge optimale de la douleur doit dorénavant faire la synthèse entre les progrès considérables des neurosciences et de l’éthologie, les découvertes pharmacologiques, les recommandations de l’Evidence Based Medicine, les observations cliniques réalisées sur de grands échantillons et l’adaptation thérapeutique personnalisée en replaçant l’animal au cœur des mécanismes intimes de la construction de sa douleur.
C’est pourquoi CAPdouleur suggère l’utilisation du tramadol en tant qu’antalgique de secours ou de traitement palliatif de la douleur, avec les conditions cumulatives suivantes :
1. Prise en charge multimodale et pluridisciplinaire de la douleur
2. Réévaluation fonctionnelle et émotionnelle de la douleur
3. Titration obligatoire et raisonner plutôt en surface corporelle pour limiter la sédation
4. Information du propriétaire sur le rapport bénéfices/risques, sur la variabilité des effets analgésiques et donc sur la nécessité d’évaluer les résultats (éducation thérapeutique), sur l’objectif de diminuer le ressenti émotionnel de la douleur.
Bibliographie Tramadol
1 Budsberg SC, Torres BT, Kleine SA, Sandberg GS, Berjeski AK. Lack of effectiveness of tramadol hydrochloride for the treatment of pain and joint dysfunction in dogs with chronic osteoarthritis. J Am Vet Med Assoc. 2018 Feb 15;252(4):427-432
2 D.C. Brown, R.C. Boston, and J.T. Farrar : Comparison of Force Plate Gait Analysis and Owner Assessment of Pain Using the Canine Brief Pain Inventory in Dogs with Osteoarthritis. J Vet Intern Med 2013;27:22–30
3 Malek S, Sample SJ, Schwartz Z, et al. Effect of analgesic therapy on clinical outcome measures in a randomized controlled trial using client-owned dogs with hip osteoarthritis. BMC Vet Res 2012;8:185.
4 Calvino B. Les bases neurales de la douleur. Psychol NeuroPsychiatr Vieil 200
6;4(1):7-20
5 Le Bars D. Bull. Acad. Vét. France. 2010 – Tome 163 – N°4/5 ; pp 315- 332
Pour aller plus loin

Retrouvez les résultats de l’enquête de pratiques de prescription de décembre 2019.





