Epidurale chez les petits mammifères
L’épidurale ou péridurale ou bloc neuroaxial, permet une analgésie préventive en injectant une molécule anesthésique ou analgésique dans l’espace épidural entourant la moelle épinière.
Indications
Les épidurales peuvent être réalisées en vue d’une chirurgie abdominale, d’une chirurgie périnéale, d’une chirurgie orthopédique impliquant le membre pelvien ou le rachis. Certains opioïdes peuvent aussi diffuser crâniale ment pour permettre une analgésie complémentaire lors de chirurgie thoracique et de chirurgies touchant le membre thoracique. Les épidurales sont un complément aux analgésique systémiques, et l’analgésie épidurale permet aussi de diminuer les doses d’anesthésiques nécessaires pour réaliser une chirurgie.
Les épidurales permettent aussi de diminuer le temps de réveil (Sladky 2000).
Malgré de nombreux bénéfices, les cliniciens hésitent souvent à réaliser des épidurales chez les petits mammifères, cependant cette technique est relativement sécuritaire, facile à réaliser et efficace.
Potentiels effets secondaires
Un des effets secondaires potentiels des épidurales est une parésie ou une paralysie transitoire. D’autres effets secondaires, bien que rares, sont décrits lors d’épidurales utilisant des opioïdes : prurit, vomissement ou nausée, dépression respiratoire, rétention urinaire.
Contre-indications
Les injections épidurales sont contre-indiquées chez les patients souffrant de coagulopathies, de sepsis, d’infections dermatologiques, de lésions dermatologiques au niveau de la zone d’injection, d’hypovolémie, ou lors de fracture pelvienne ou sacrée déformant les repères anatomiques.
Equipement nécessaire
Pour réaliser une épidurale, sont nécessaires :
- Gants stériles
- Compresses tièdes imbibées de solution désinfectante
- Cathéter épidural de taille appropriée : lapin et furet cathéter épidural 22 ou 24-gauge, chinchilla ou cobaye 24 ou 25-gauge
- NaCl
- Produit à injecter en épidural: la molécule sélectionnée doit-être exempte de tout conservateur afin d’éviter toute réponse neurotoxique ou allergique. La morphine est l’opioïde le plus utilisé à cause de son efficacité analgésique et de sa durée d’action. Il est recommandé d’utiliser 0,1mg/kg de morphine chez le furet et 0,22mg/kg de morphine chez le lapin.
- Les anesthésiques locaux peuvent être administrés en épidural seul ou avec un opioïde.
La bupivacaïne (0.1mg/kg chez le lapin) est une molécule de choix car il apparait qu’elle a moins d’effets de blocage moteur tout en ayant un bon blocage sensitif. Les petits mammifères, en particulier les lapins, peuvent devenir très stressés au cours du réveil s’ils sont incapables de bouger leurs pattes arrières. Les effets des blocs épiduraux progressent caudaux-crânialement. Le volume utilisé influence la migration crâniale de la molécule.
Le volume total de molécule utilisée ne doit jamais dépasser les 0.33ml/kg.
Réaliser une injection épidurale
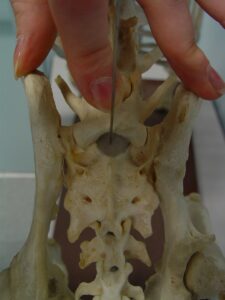
Pour réaliser une injection épidurale, le patient doit être induit et immobile. Placer le patient en décubitus sternal avec les hanches fléchis crânialement afin de complétement ouvrir l’espace lombo sacré. Visualiser la ligne virtuelle transverse qui connecte ces deux points (figure 1).
La jonction lombosacrée se trouve au milieu de cette ligne virtuelle. Palper le processus épineux
et l’espace lombo sacré.
Raser les poils autour de l’espace lombo sacré. Cet espace doit être assez large pour pouvoir voir les points de repère osseux et maintenir une stérilité lors de la procédure. Préparer de manière aseptique la peau.
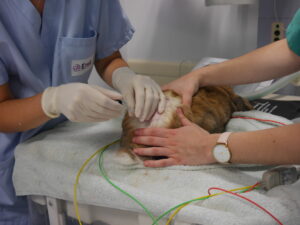
Tenir le cathéter épidural perpendiculaire par rapport à la peau. Insérer le cathéter précisément sur la ligne médiale, caudalement à la dernière vertèbre lombaire (figure 2).
Le cathéter doit passer sans rencontrer une résistance au moment de passer la peau et au moment de passer le ligament jaune. Chez les plus petits individus, la résistance au moment de passer le ligament jaune ne sera pas ressenti. Bloquer la position du cathéter avec le pouce et l’index une fois le ligament jaune passé. Si le cathéter est enfoncé un peu trop loin, celui-ci viendra buter sur le corps vertébral. Dans ce cas-là, retirer le cathéter d’1mm.
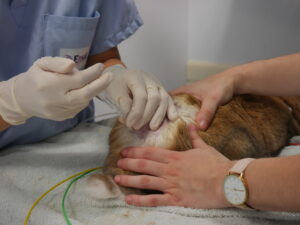
Pour confirmer le placement correct de l’aiguille : monter une seringue contenant 0.2ml de NaCl stérile combiné avec 0.2ml d’air, la bulle d’air étant positionnée contre le piston. Il doit y avoir une absence de résistance au moment de cette injection si le cathéter est bien dans l’espace épidural : la bulle d’air ne doit pas se comprimer au moment ou l’on appui sur la seringue pour injecter le NaCl (Figure 3).
S’il y a une résistance à l’injection de l’air ou si la peau gonfle, avancer l’aiguille jusqu’à ce qu’il passe complétement le ligament jaune, et vérifier la résistance une nouvelle fois. Une fois que l’aiguille est bien en position, remplacer la seringue vide par celle contenant l’agent anesthésique. Doucement injecter la molécule dans l’espace épidural. Une injection rapide peut entrainer une distribution inégale de la molécule dans l’espace épidural et même entrainer une augmentation de la pression intracrânienne.
Bien veiller à vider la vessie du patient avant que celui-ci ne se réveille de son anesthésie. Le tonus vésical et sphinctérien devrait être de retour avant que la vessie ne soit de nouveau remplie.
L’injection épidurale fait elle effet ?
Une épidurale réussie entraine une perte de tonus sphinctérien, une perte du tonus de la queue, ainsi qu’une chute de la pression artérielle. Cela peut mettre jusqu’à 15-30 minutes pour que les effets analgésiques soient atteints. Les effets peuvent durer de 8 à 24 heures.
Références
An NO, Evans HE. Anatomy of the ferret. In: Fox JG (ed). Biology and Diseases of the Ferret. Lea & Febiger, Philadelphia; 1988. Pp. 14-65.
Coulter CA, Flecknell PA, Leach MC, Richardson CA. Reported analgesic administration to rabbits undergoing experimental surgical procedures. Vet Res 7: 12, 2011
Eshar D, Wilson J. Epidural anesthesia and analgesia in ferrets. Lab Anim 39(11):339-340, 2010.
Greenaway JB, Partlow GD, Gonsholt NL, Fisher KR. Anatomy of the lumbosacral spinal cord in rabbits. J Am Anim Hosp Assoc37(1):27-34, 2001.
Harms CA, Sladky KK, Horne WA, Stoskopf MK Epidural analgesia in ferrets. Exotic DVM 4(3):40-42, 2000.
Konakci S, Adanir T, Yilmaz G, Rezanko T. The efficacy and neurotoxicity of dexmedetomidine administered via the epidural route. European Journal of Anaesthesiology 25(5):403-409, 2008.
Morimoto K, Nisimura R, Matsunaga S, et al. Epidural analgesia with a combination of bupivacaine and buprenorphine in rats. J Vet Med A Physiol Pathol Clin Med 48(5):303-312, 2001.
Sladky KK, Horne WA, Goodrowe KL, et al. Evaluation of epidural morphine for postoperative analgesia in ferrets (Mustela putorius furo). Contemporary topics in Laboratory Animal Science 39(6):33-38, 2000.
Wynn RL, Essien E, Thut PD. The effects of different antiemetic agents on morphine-induced emesis in ferrets. Eur J Pharm 241:47-54, 1993.